
Come abbiamo detto nei capitoli precedenti la corrosione è strettamente legata ai fattori ambientali, infatti senza l’ambiente verrebbe a mancare il conduttore di seconda specie (la soluzione elettrolita) tra i due metalli e non ci sarebbe corrosione affatto. Gli ambienti nella realtà sono infiniti e infinitamente vari, qui vedremo le difficoltà generali di alcuni ambienti molto specifici, in particolare:
- Aria (fattori importanti: umidità, sali disciolti, piogge acide)
- Acqua dolce (fattori importanti: durezza, turbolenza, sali disciolti)
- Acqua salata (fattori importanti: salinità, profondità )
- Terreno (Fattori importanti: Umidità, conducibilità, porosità, linee di terra)
- Calcestruzzo (fattori importanti: acqua residua, porosità, chimica del CLS)
- Alta temperatura (fattori importanti: unico caso di corrosione a secco)
Come vediamo quasi in tutti i casi il problema è sempre l’areazione differenziale tra una parte e l’altra del pezzo ed è una cosa che molto spesso non è possibile correggere se non in sede di progetto scegliendo un materiale o un insieme di materiali adeguati a quella situazione
Corrosione in ambiente aria
In aria i fattori da tenere in considerazione sono innumerevoli, ma principalmente sono tutti dipendenti dall’umidità relativa dell’aria.
La composizione dell’aria è circa 21% ossigeno, 78% azoto e, i valori che ci interessano, dallo 0 al 5 % di vapore e 390-500 PPM di Anidride carbonica.
Il vapore dipende molto dalle condizioni atmosferiche e dalla zona (zone desertiche molto secche, zone tropicali molto umide).
Corrosione per umidità
Per i nostri scopi esiste un parametro Tau, detto anche “tempo bagnato” che ci aiuta a capire quanto tempo la nostra struttura passerà toccata dell’acqua.
Questo è il periodo di tempo in un anno in cui circa la cella galvanica è attiva e ci permette quindi di calcolare la corrosione. Facciamo un esempio
Mettiamo che tramite le equazioni di Nernst otteniamo che la superficie viene corrosa ad una velocità di 0,004 mm all’anno. Ma sappiamo che il pezzo sarà esposto all’umidità per 2500 ore all’anno (ossia il 30% del tempo), allora la velocità di corrosione sarà il 30% della velocità calcolata con Nernst.
C’è un altro fattore importante, ovvero la presenza di sali igroscopici, ovvero sali che accumulano acqua che quindi peggiorano la situazioni.
Un fattore che influenza è l’esposizione al sole (asciuga molto più velocemente) e il colore (capacità di assorbire il calore).
Altri agenti
Altri agenti sono sicuramente l’ossigeno (lo spessore dell’elettrolita potrebbe portare ad una corrosione localizzata simile alla corrosione sotto le gocce), l’anidride carbonica presente nell’aria data la sua propensione a creare dei carbonai metallici (come i carbonai di zinco o di rame). Inoltre se combinato all’acqua la rende più acida cambiando le condizioni di cella e risalendo il diagramma di Poisson. Meccanismo simile vale per i solfuri, i solfati e gli acidi solforici.
Un piccolo aneddoto aggiuntivo per quanto riguarda gli escrementi di volatili e gli acidi contenuti all’interno. Questo fattore accelera o modifica la corrosione creando un ambiente acido e ricco di ioni OH-.

Forme di corrosione in atmosfera
In aria abbiamo tutta la varietà di forme di corrosione. Si parte dalla più comune corrosione generalizzata per i metalli esposti, alla corrosione localizzata dei materiali con superfici protette.
Corrosione in ambiente acqua dolce
L’acqua dolce o in generale l’acqua non è un conduttore, ma i sali disciolti al suo interno lo fanno diventa il perfetto conduttore di seconda specie tra i 2 metalli.
Inoltre le possibili incrostazioni causate da calcare o altri sali disciolti aiutano a creare delle microcelle galvaniche a concentrazione.
In acqua le caratteristiche che influenzano la corrosione sono alcalinità (presenza di sali alcalini o di calcare), durezza, ovvero il contenuto di ioni di calcio e magnesio che concorrono alla formazione di calcare.
L’acidità rappresentata dalla percentuale di anidride carbonica disciolta in acqua e infine il potere incrostante dell’acqua (appunto formazione di celle galvaniche a concentrazione)
In realtà il potere incrostante non per forza è un male, infatti se la “crosta” è uniforme e compatta questa funge da film protettivo del metallo.
Il potere incrostante si calcola risolvendo dei sistemi a equilibri multipli.
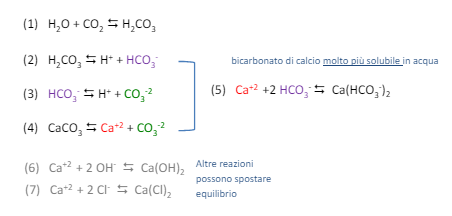
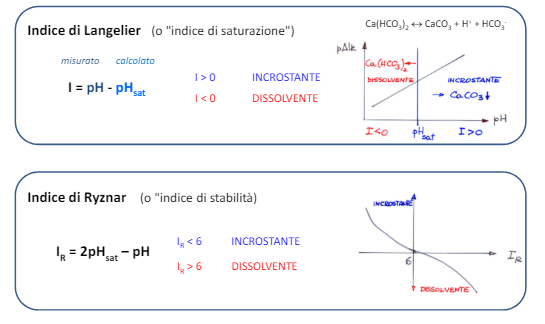
Possiamo valutare il potere incrostante di un’acqua tramite alcuni indici teorici in funzione al pH di saturazione che si calcola in questo modo

Altri fattori importanti da considerare sono la conducibilità (sempre relativa alla quantità di ioni disciolti e dal tipo di ioni disciolti), l’ossigeno disciolto e la componente biologica che con i suoi scarti o tramite le attività vitali stesse possono andare a corrodere il materiale.
Corrosione in ambiente acqua marina
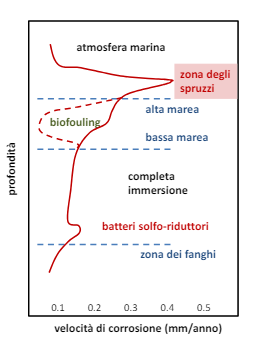
In acqua marina abbiamo gli stessi problemi dell’acqua dolce, inoltre abbiamo degli aspetti peggiorativi come la presenza di ioni di cloro, correnti marine e sabbia/ particolato abrasivo in sospensioni. Inoltre c’è un gradiente di potenziale, salinità e concentrazione di ossigeno al variare della profondità.
Inoltre la presenza di ini di sodio e modificano la scala dei potenziali di riduzione nobilitando alcuni metalli (come il titanio) e de-nobilitando altri come l’oro.
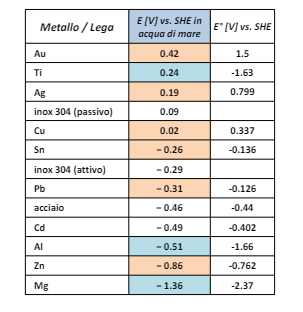
L’acqua di mare tendenzialmente aumenta la velocità di corrosione dato che si tratta di un liquido elettrolita, in moto, ricco di particolato, con altezza variabile e popolato da batteri e alghe.
Corrosione in ambiente terreno
Il terreno è un ambiente molto variabile da sito a sito, tendenzialmente il fattore più importante è la porosità. Questa permette il passaggio dell’aria e dell’acqua e varia quindi le condizioni. Queste caratteristiche sono quindi dettate dalla granulometria dei terreni oltre ad altri fattori ambientali. Altro fattore importante è la presenza dell’uomo: scaricando le linee di terra appunto a terra creiamo un potenziale locale che permette di agevolare i processi di corrosione.
Inoltre nel terreno c’è una forte presenza di sali che in presenza di acqua si disciolgono e vanno a variare pH e condizioni del conduttore elettrolitico (acqua). Tendezialmente si trattano di sali di cloro, zolfo e carbonati. I primi riducono il campo di passività mentre i secondi possono aiutare la passivazione. Questi fanno tendere il pH dei terreni tra il 5 e l’8, quindi terreni tendenzialmente acidi o neutri.
Inoltre in terra c’è molta attività biologica e gli scarti di quest’ultima aiuta la produzioni di ioni solfati e solfiti.
La condizione ideale è quella di un terreno areato, con granulometria grossa e in assenza di sali. In caso di presenza di carbonati c’è la possibilità di una precipitazione dei carbonati sul metallo creando quindi dei sistemi di corrosione e locale.
Dato che il terreno spesso è disomogeneo e può variare la sua granulometria e la sua composizione a distanza di pochi metri, uno dei problemi può essere la cella ad areazione differenziata, ovvero lo stesso tubo che attraversa un terreno misto si comporta:
- in maniera catodica nella sezione a porosità maggiore
- in maniera catodica nella sezione più compatta
Corrosione in ambiente biologico
Per ambiente biologico si intendono gli ambienti che hanno a che fare con il corpo umano. Si prendono in considerazione quindi tutti quei metalli chirurgici che o rimangono a contatto con il corpo per un tempo limitato o vengono impiantati in maniera permanente come per esempio viti per ossa, protesi dell’anca o del ginocchio eccetera.
In ambiente biologico abbiamo 2 tipi di macroambienti: extra corpore (ovvero tutte le strumentazioni che hanno un contatto con il corpo limitato) o in corpore (tendenzialmente rotesi o sistemi meccanici permaneti).
Per i metalli extra corpore l’ambiente riserva loro la presenza di detergenti, farmaci e disinfettanti tipicamente composti da cloruri o soluzioni ossigenate entrambe deleterie per quanto riguarda la corrosione. Il materiale tipicamente usato è il famoso “acciaio chirurgico”, ovvero un acciaio ad altissimo contenuto di cromo e con un basso tenore di carbonio. Questo è l’acciaio utilizzato anche per i piercing di media qualità ad esempio.
In caso di problemi dati da corrosione generalizzata è possibile inserire in microlegato del molibdeno per ottimizzare le prestazioni del film passivante del cromo.

Per i metalli in corpore invece deve affrontare l’interno del nostro corpo, ricco di ioni cloro, ossigeno, ma soprattuto estremamente conduttivo (è come essere in acqua salata a livello di conducibilità).
In ambiente biologico la morfologia più comune è quindi la corrosione galvanica e la corrosione assistita (sforzo o fatica).
Corrosione in ambiente calcestruzzo
La corrosione all’interno del calcestruzzo è un fenomeno particolarmente complesso a causa delle caratteristiche specifiche di questo materiale. Il calcestruzzo è per sua natura poroso e può contenere acqua residua e vari agenti chimici che influenzano il processo corrosivo. Uno dei principali problemi è la carbonatazione, un processo in cui l’anidride carbonica penetra nel calcestruzzo e reagisce con l’idrossido di calcio presente, abbassando il pH dell’ambiente e compromettendo lo strato passivante che protegge l’acciaio dall’ossidazione.
Un altro fattore critico è la penetrazione di cloruri, spesso presenti nei sali antighiaccio o nell’ambiente marino, che può causare corrosione pitting localizzata dell’armatura in acciaio. La presenza di microfessure nel calcestruzzo può ulteriormente accelerare questi processi permettendo un più facile accesso degli agenti corrosivi all’interno. La combinazione di questi fattori può portare a una significativa riduzione della durata della struttura in calcestruzzo armato, rendendo essenziale un’attenta progettazione e manutenzione per mitigare i rischi di corrosione.
Corrosione in ambiente ad alta temperatura
La corrosione ad alta temperatura rappresenta un caso unico di corrosione a secco, dove il principale agente corrosivo è l’ossigeno presente nell’aria. Questo tipo di corrosione è rilevante in ambienti industriali dove i metalli sono esposti a temperature elevate, come nei forni, nei motori e negli impianti di produzione di energia. A queste temperature, gli ossidi metallici formati possono non fornire un’adeguata protezione passivante, come avviene a temperature più basse. Ad esempio, l’ossidazione del ferro a temperature elevate può portare alla formazione di ossidi che si distaccano facilmente dalla superficie, esponendo continuamente il metallo nudo all’ossigeno e accelerando il processo corrosivo.
Alcuni metalli e leghe, come l’acciaio inossidabile e le superleghe a base di nichel, sono progettati per formare strati di ossidi protettivi stabili che possono rallentare il processo di ossidazione. Tuttavia, la presenza di gas corrosivi come zolfo e cloro a temperature elevate può complicare ulteriormente il quadro, poiché questi possono formare composti con i metalli che accelerano la corrosione. Pertanto, la selezione dei materiali per applicazioni ad alta temperatura deve tenere conto non solo della resistenza meccanica ma anche della capacità di formare strati protettivi stabili in condizioni operative specifiche.
Anche per oggi è tutto. Se volete vedere altri articoli della serie di corrosione cliccate qui. Invece per rimanere aggiornati sulle novità pigia qui!!!
