
La corrosione è un processo naturale e inarrestabile che consuma i metalli e ne diminuisce le caratteristiche tecniche. Questo articolo (che per me sarà un ripasso generale hehe) parlerà della chimica di questo processo e di come provare a limitarlo.
Introduzione alla corrosione
Ognuno di noi ha visto almeno una volta un pezzo di acciaio arrugginito e si è domandato: “ma che è successo e perché questo acciaio è arruginito e quest’altro no?”.
Innanzitutto, cos’è la corrosione?
detta in poche parole è un processo chimico che comporta in consumo di un metallo, e viene definito anche come anti-metallurgia.
I processi corrosivi come vedremo sono “termodinamicamente favoriti” per la maggior parte dei metalli.
Infatti pochissimi metalli si trovano in natura allo stato metallico mentre la maggior parte di loro si trova sottoforma di ossidi (vedi per esempio il ferro) o sottoforma di sali (vedi per esempio il litio).
Questo è dovuto appunto alla termodinamica, in particolare alla legge del “gli elementi vogliono avere il livello di energia più basso possibile”
Per poter comprendere al meglio i processi di corrosione facciamo un bel ripassino di elettrochimica.
Il processo come scritto nel titolo è inarrestabile, ma controllabile. Infatti è possibile ridurre i danni innanzitutto progettando in maniera cosciente e soprattutto prescrivendo un monitoraggio e una manutenzione adeguata
L’elettrochimica della corrosione
Quando parliamo di corrosione la chimica fa riferimento alla cella elettrolitica, ovvero sostanzialmente alle batterie.
Ma partiamo dal concetto di energia libera di reazione, ovvero un parametro che ci dice se la reazione è spontanea (quindi l’energia dei prodotto è inferiore all’energia dei reagenti) o se ha bisogno di energia per essere sviluppata.
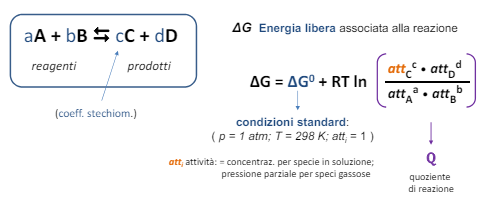
detto ciò vogliamo portare questa energia da un concetto teorico ad un concetto pratico. Ricordiamo quindi che la variazione di energia è un lavoro, come quello del lavoro elettrico. Infatti esiste una relazione tra la variazione di energia libera di Gibbs e il lavoro elettrico.
Inoltre abbiamo visto appunto l’applicazione per una generica reazione chimica, ma in corrosione si parla principalmente di forme ridotte e forme ossidate di un metallo.
Piccolo reminder per tutti i chimici all’ascolto, forma ossidata non vuol dire che ci sia un ossigeno attaccato, ma semplicemente che l’elemento ha “perso elettroni”, al contrario forma ridotta vuol dire che l’elemento ha “guadagnato elettroni”


Con queste conoscenze acquisite ora possiamo calcolare il potenziale teorico di una cella elettrochimica
La cella elettrochimica
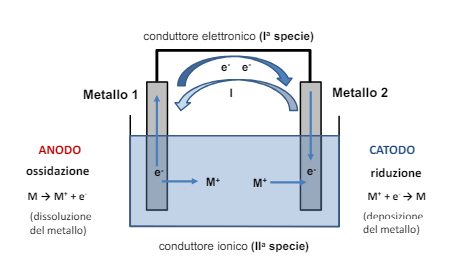
Vediamo che nella cella avvengono 2 reazioni su 2 metalli differenti.
L’anodo è il metallo che si consuma (il metallo si discioglie come ione perché perde elettroni) mentre il catodo è la “sede della reazione catodica”, ovvero una reazione che consuma gli elettroni prodotti dall’anodo. Nella teoria abbiamo la “deposizione” dello ione metallico sul catodo. Questo processo può avvenire e viene usato appunto per galvanizzare dei pezzi (per esempio i pezzi cromati sono fatti in questo modo). Nel campo della corrosione invece i processi catodici molto raramente sono di deposizione del metallo, ma visto l’ambiente ricco di acqua saranno i processi di riduzione dell’ossigeno e di formazione idrogeno dalla soluzione.

Lo schema del processo corrosivo
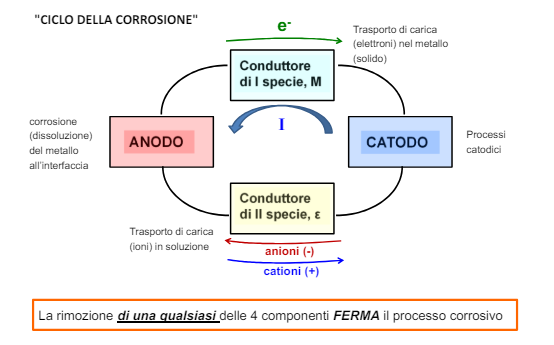
Il processo di corrosione inoltre ha altri 2 componenti, ovvero i 2 conduttori. Questi sono quelli che permettono il passaggio di elettroni dall’anodo al catodo.
Se non ci fosse questo spostamento di elettroni da un metallo ad un altro non ci sarebbe corrosione perché appunto il metallo dell’anodo non perderebbe elettroni e quindi non perderebbe ioni metallici nella soluzione.
La corrosione, i fattori che la guidano
Fino ad adesso abbiamo visto la chimica dietro la corrosione, ma appunto è un processo complesso e guidato da innumerevoli fattori tra cui i principali sono i metalli e l’ambiente.
Abbiamo visto fino ad adesso la chimica tra 2 metalli, ma se avete fatto caso nell’equazione di Gibbs è segnata l’attività, e l’attività dell’ossigeno è la sua pressione parziale sul pezzo. Questo implica purtroppo che non solo c’è corrosione tra un anodo di un metallo e un catodo di un altro, ma zone dello stesso materiale a seconda dell’esposizione si possono comportare come anodo o come catodo rispetto ad un altra.
Per oggi è tutto, questa sarà una nuova serie e qui troverete le altre parti. Mentre per le novità cliccate qui!!
Alla Prossima.
