Dopo aver visto gli accenni di elettrochimica andiamo ad approfondire uno dei 2 aspetti della chimica della corrosione, ovvero la termodinamica di corrosione.
Questo aspetto è quello che risponde alla domanda : “può avvenire spontaneamente?”
Da qui la situazione diventerà molto tecnica e spero di far comunque trasparire qualcosa di interessante.
Iniziamo
I metalli e gli elettrodi di riferimento
Abbiamo visto la reazione anodica, ovvero gli elettroni vanno via e gli ioni metallici di disciolgono in una soluzione. Questa è una reazione di equilibrio e questo implica che prima dell’equilibrio (ovvero prima che il metallo smetta di sciogliersi), tra il metallo e la soluzione c’è una differenza di potenziale che fa avvenire la reazione. Questa differenza di energia non è misurabile, ma come abbiamo visto è possibile misurare la differenza di potenziale tra un anodo e un catodo.
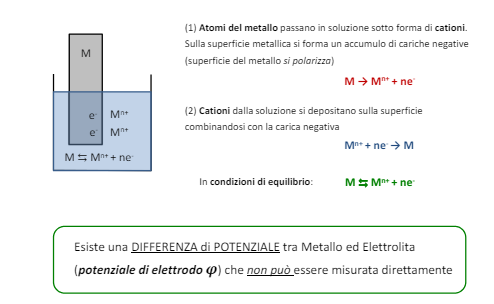
Quindi è necessario utilizzare un riferimento e quello più utilizzato è l’idrogeno utilizzato in questo modo.
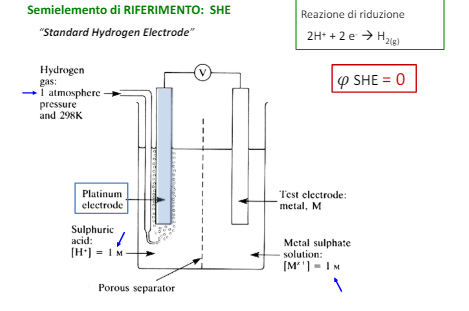
Si considera quindi il potenziale dell’elettrodo SHE come zero e da qui tramite esperimenti è possibile creare una scala di potenziali per ogni reazione di riduzione. ATTENZIONE: questa scala è la scala dei poteziali di RIDUZIONE, ovvero nella formula chimica la direzione di formazione dei metalli solidi.
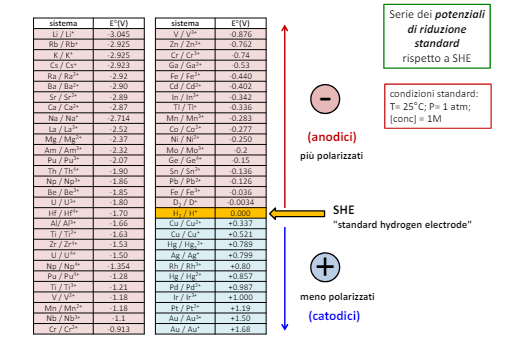
Vediamo infatti che dal lato dei metalli catodici troviamo tutti i metalli che si trovano allo stato metallico in natura, mentre dall’altro lato tutti i metalli che troviamo in forma di ossidi. Notiamo inoltre che il potenziale da un lato e l’altro cambia di segno.
Forza elettromotrice di cella galvanica
Data questa tabella allora possiamo capire i potenziali di cella, ovvero l’energia “accumulata tra 2 elettrodi” sottoforma di potenziale elettrico. Vediamo alcuni esempi:

in generale per una cella non in condizioni standard s utilizza l’equazione di NERNST
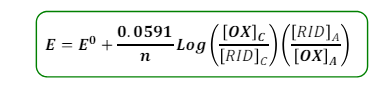
Vediamo che non è altro che un fattore correttivo delle condizioni standard. Il valore di 0,0591 è dato dalla moltiplicazione dei valori di (RT/F) * ln/LOG
E osserviamo una cosa importantissima, ovvero che le attività non sono strettamente dipendenti dalle reazioni in corso, ma dalle concentrazioni. Infatti è possibile avere una cella galvanica composta con 2 elettrodi dello stesso materiale ma con concentrazioni diverse.
Il processo della cella a concentrazione lo ritroviamo in moltissimi processi corrosivi, principalmente la concentrazione che varia è quella di ossigeno.
Stabilità termodinamica dell’acqua
Abbiamo visto appunto che i processi catodici sono dati dall’acqua, ovvero dipendono dalle concentrazioni di ioni H nell’acqua (pH) e di ioni OH (pOH). Quindi svolgendo le equazioni di Nernst in funzione del pH otteniamo il “campo di esistenza dell’acqua”. Ovvero a quale potenziale e quale pH troviamo acqua stabile, dove l’acqua si ossida (sviluppo ossigeno) o dove l’acqua si riduce (sviluppo idrogeno).
Queste reazioni vanno a formare le due linee più importanti per la termodinamica di corrosione sul diagramma di Pourbaix che vedremo dopo.

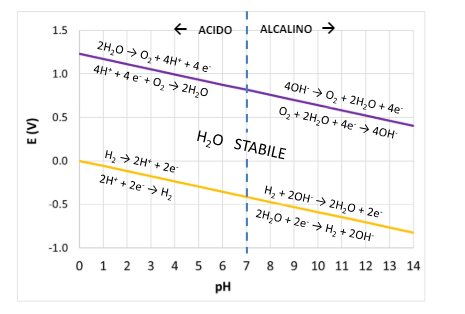
Come abbiamo visto i metalli vanno in corrosione solo se esiste un potenziale catodico maggiore di un potenziale anodico. Dato che le reazioni avvengono con l’acqua vediamo che:
- In ambiente acido non areato (senza O2) ossidano i metalli con potenziale di riduzione minore di 0 V
- In ambiente acido areato (con O2) tutti i metalli con potenziale di riduzione inferiore a 1,23 V
- In ambiente neutro non areato (senza o2) ossidano i metalli con potenziale di riduzione minore di -0.41 V
- In ambiente neutro areato (con O2) tutti i metalli con potenziale di riduzione inferiore a 0.82 V
- In ambiente basico non areato (senza O2) tutti i metalli con potenziale di riduzione inferiore a -0.83V
- In ambiente basico areato (con O2) tutti i metalli con potenziale di riduzione inferiore a +0.40 V

Diagrammi di Pourbaix
Possiamo ora con lo stesso procedimento sul grafico creare le rette di esistenza di una determinata specie chimica rispetto ad un’altra (equilibrio metallo-ione metallico, equilibrio ione metallico – idrossido, equilibrio metallo idrossido) e sovrapporla al grafico di esistenza dell’acqua. Questo tipo di diagrammi è uno dei pilastri fondanti su cui si basa la termodinamica di corrosione.
Otteniamo circa un diagramma di questo tipo.
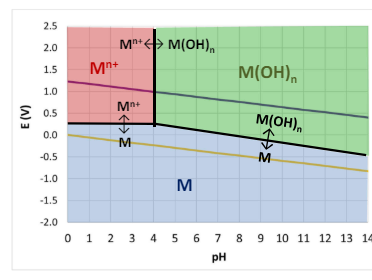
Principalmente appunto otteniamo 3 zone:
- rosso: corrosione
- verde : passivazione
- blu: immunità
In realtà c’è un problema nella passivazione, ovvero il grafico di Pourbaix non ci da indicazioni riguardanti la qualità della passivazione, quindi non è sicuro che effettivamente ci sia un ossido passivante o un idrossido passivante, ma segna solo la formazione di ossidi e idrossidi.
Vediamo qualche esempio
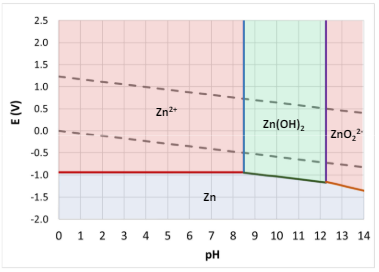
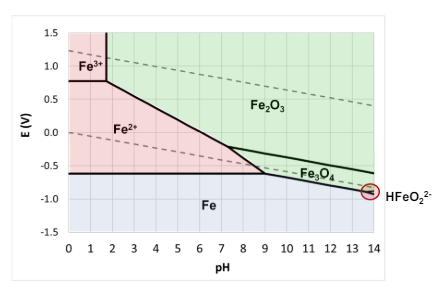
In nessuno di questi 2 casi c’è l’immunità, e infatti entrambi (sia zinco che ferro) non sono presenti in forma metallica in natura e entrambi sono soggetti a corrosione in qualsiasi circostanza in cui esiste l’acqua.
Le zone di immunità in realtà generano idrogeno che può intossicare i metalli (vedasi idrogeno e acciaio)
In questo caso vediamo rame e oro che esistono metallici in natura e che, in particolare l’oro vediamo che è immune in qualsiasi condizione.
Per quanto riguarda la termodinamica di corrosione è tutto.
Anche per oggi è finisce qui. Per rimanere aggiornati pigia qui, per altri articoli, anche quelli della serie “la corrosione”, pigia quii!!
