La morfologia, ovvero come si presenta la corrosione, è caratterizzata dalla forma e dalla “driving force”, ovvero il tipo di chimica che alimenta la corrosione.
Le driving force sono principalmente 2, ovvero il contatto galvanico e la cella ad areazione differenziata.
Mentre le 3 macro-famiglie di corrosione sono corrosione generalizzata, corrosione localizzata e corrosione selettiva.
Morfologia di corrosione: Corrosione generalizzata
La corrosione si divide in
- Corrosione uniforme
- Corrosione non uniforme
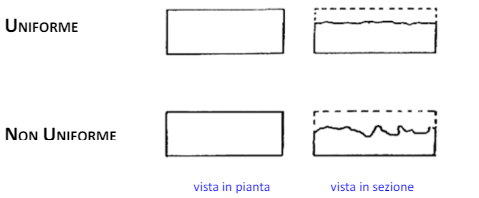
L’uniformità di corrosione è data dalla finitura superficiale, infatti dall’elettrotecnica sappiamo che le correnti si accumulano sugli spigoli. Infatti più le valli e i picchi sono arrotondati, più la corrosione sarà uniforme. Per esempio la prima parte ad andare via per corrosione delle viti sono proprio i filetti che sono fatti di una cresta sottile su cui si accumula l’intera corrente di corrosione. Una delle lavorazioni più comuni infatti per limitare la corrosione è la butturatura.
Tendenzialmente la corrosione generalizzata è data dal contatto galvanico tra 2 metalli con nobiltà differente
I fattori da considerare nella corrosione generalizzata sono:
- Differenza di nobiltà pratica
- Proprietà catalitiche (il catodo può aiutare la corrosione tramite reazioni catalitiche)
- Rapporto tra le aree
- Conducibilità e composizione della soluzione (conduttore di tipo 2)
Differenza di nobiltà pratica
Nella teoria abbiamo studiato l’esistenza dei potenziali di riduzione standard, ma questi sono stati calcolati in ambienti di laboratorio, quindi è molto probabile che alcune differenze di potenziale rispetto allo standard in condizioni naturai vengano sfalsate. Dato che la natura è imprevedibile si è scelto di affrontare il problema tramite una soluzione empirica.
Ovvero per la compatibilità tra 2 metalli e per evitare un fenomeno corrosivo disastroso (ovvero la corrosione rapida dell’anodo) si è scelto di utilizzare una differenza di potenziale di riduzione tra i due metalli inferiore a 0,25V

In questa tabella ad esempio abbiamo che i materiali in classe 5 faranno da anodo a quelli di classe inferiore. Idealmente quando costruiamo una struttura infatti sarebbe cosa buona farla tutta dello stesso materiale, in particolare i giunti di connessione causano non pochi problemi.
In questi casi sono possibili dei ribaltamenti di comportamento. Per esempio sappiamo dalla termodinamica che lo zinco è meno nobile del ferro, ma a temperature elevate l’ossido che si crea non è più isolante ma semiconduttivo e quindi lo zinco diventa catodico rispetto al ferro.
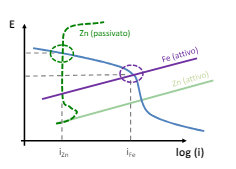
Appunto qui abbiamo che lo zinco passivato ha una tensione di lavoro maggiore rispetto alla reazione di riduzione ossigeno, e quindi farà da catodo rispetto al ferro.
Proprietà catalitiche del catodo
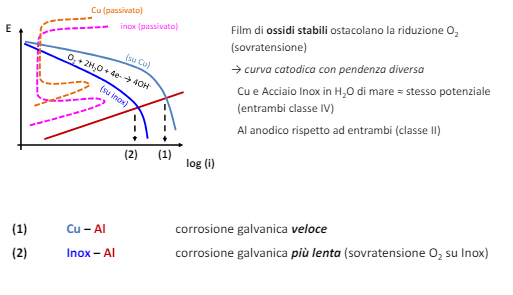
Anche per il catodo la condizione superficiale è determinante, infatti ad esempio un film di ossidi stabili posizionati sul catodo crea una sovratensione che ostacola la reazione sul catodo.
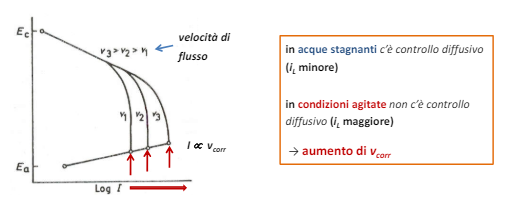
Un altro fattore determinante è la concentrazione di ossigeno dato che la pressione parziale di ossigeno determina la velocita della reazione catodica (vedi equazione di Nernst), infatti in acque stagnati la corrosione spesso è lenta o addirittura trascurabile, mentre in acque agitate la corrente di corrosione è molto elevata appunto per la reazione veloce di produzione ossigeno.
Rapporto tra le aree
Abbiamo già visto nella cinetica di corrosione che il rapporto tra le aree delle interfacce dei 2 metalli è strettamente correlato, infatti dato che la corrosione è un effetto superficiale, la profondità di corrosione sarà più veloce tanto quanto l’area del catodo è piccolo.
Morfologia di corrosione: Corrosione Localizzata
Come per la corrosione generalizzata, anche per la corrosione localizzata ci sono 3 sottofamiglie, ovvero:
- Vaiolatura (pitting)
- Fessura (Crevice)
- Filiforme (sotto film protettivo)
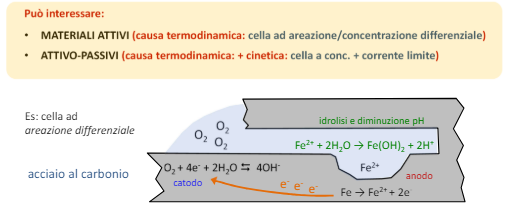
La driving force di questo tipo di corrosione è principalmente la cella ad areazione differenziata
Generalmente questo tipo di corrosione non avviene su materiali attivi, ma su materiali protetti o da vernici o film passivanti e vengono innescati proprio dalla rottura di questa protezione.
La rottura può avvenire sia in maniera meccanica sia in maniera elettrochimica (la corrente galvanica “sfonda” il film protettivo)
Altri motivi di corrosione localizzata sono la presenza di un deposito che crea areazione differenziale in una zona localizzata della superficie e sempre con la stessa driving force all’interno delle fessure o per la presenza di gocce sul metallo.
Vaiolatura o Pitting

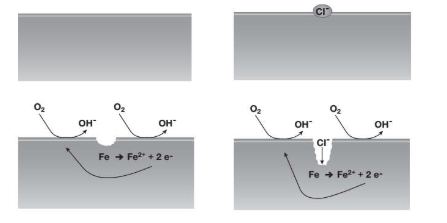
Il tipo di corrosione localizzata più pericolosa e profonda è proprio questa. La vaiolatura è tipica appunto di metalli passivati ed è innescata dalla rottura o dal cedimento del film protettivo. I danni possono avere dimensioni ridottissime, addirittura microscopiche, e presentarsi anche singolarmente. Inoltre per via del rapporto ridottissimo tra le aree di catodo e anodo abbiamo una velocità di penetrazione della corrosione estremamente elevata. Tutto questo comporta problemi estremamente, in particolare in tubature o serbatoi in pressione.
Inoltre in caso di presenza di elementi de-passivanti come il cloro, la reazione diventa auto-catalitica, ovvero la velocità di reazione aumenta per via dell’idrolisi acida nella cavità,(ovvero l’ambiente acido nella cavita porta alla produzione di più ioni metallici per bilanciare il pH molto basso).
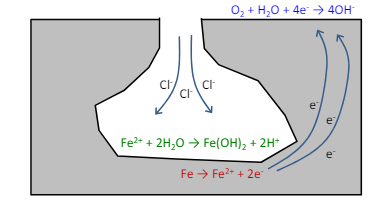
Piccolo appunto sui fattori di riduzione delle zone di passività
La zona di passività come abbiamo visto in cinematica e termodinamica della corrosione è la zona in cui si forma un ossido o idrossido protettivo sullo stesso metallo. L’esempio più lampante di metallo passivato è l’alluminio con i suoi ossidi (l’allumina in particolare).
La zona di passività è direttamente correlata all’ambiente e di conseguenza alla presenza d ioni depassivanti come il cloro appunto e del valore del pH.
E possibile inoltre che per metalli in condizioni di transpassività si attivi un ciclo di isteresi, ovvero ciclicamente la corrosione si ferma (ad esempio sul bagno-asciuga), il potenziale diminuisce e il metallo ha abbastanza tempo per ri-passivarsi e ricominciare il ciclo in transpassività.
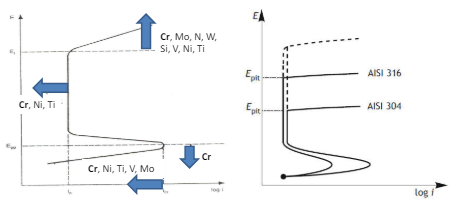
Per poter misurare la propensione di un materiale a subire fenomeni di pitting esiste un indice di resistenza al pitting detto PREN, Questo prende in considerazione la composizione del metallo.

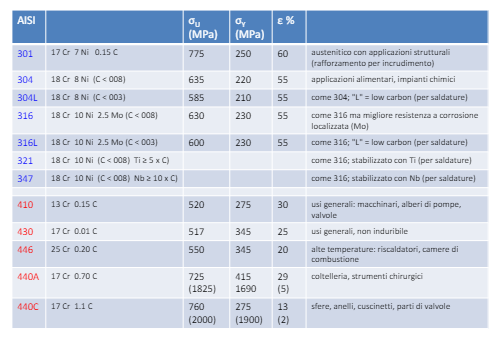
Pitting nodulare

In letteratura troviamo un caso importante, ovvero il rame in acqua dolce crea questo particolare tipo di pitting sovrastati da opercoli composti da prodotti di corrosione porosi.
Il meccanismo è tendenzialmente il seguente:
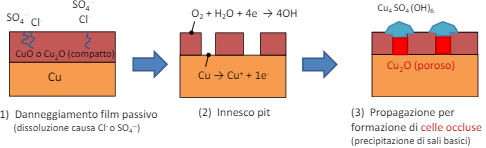
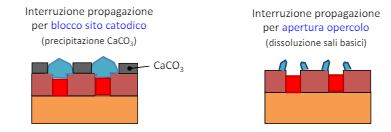
Corrosione in fessura
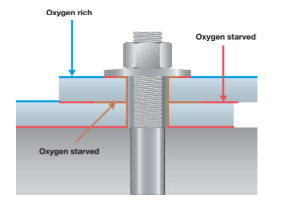
La driving force di questo tipo di morfologia di corrosione è l’areazione differenziale dovuto alla geometria delle componenti.
Tipicamente questo tipo di corrosione si presenta tra giunti metallici, interstizi sulle guarnizioni, filettature, saldature mal rifinite ecc…
La regola d’oro di questo tipo di corrosione è quella che per essere presente è necessario che l’interstizio sia sufficientemente piccolo da fare in modo che la velocità di consumo dell’ossigeno nell’interstizio sia maggiore della velocità di diffusione dell’ossigeno nello stesso.
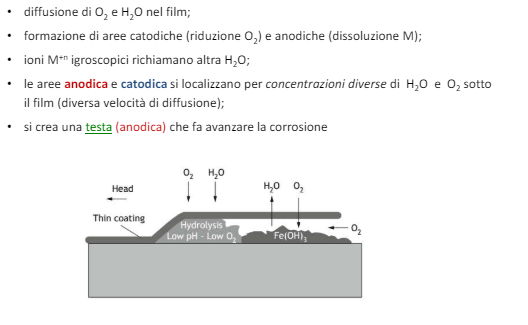
Corrosione Filiforme
Questo tipo di corrosione è tipico di metalli protetti da un film passivato o da un film protettivo. La driving force di questo meccanismo corrosivo è la cella ad areazione differenziale. In particolare vediamo che quello che succede è che a seguito di un difetto nel film protettivo si crea sotto di questo un innesco di corrosione che poi si divide per areazione differenziale in una testa anodica che “cammina” e una coda catodica. Banalmente la testa ha meno area esposta all’aria rispetto al corpo catodico e quindi si crea una sorta d corrosione in fessura.
Corrosione selettiva
La corrosione non solo può avvenire tra 2 metalli diversi, ma dato che spesso i metalli si trovano in lega tra loro, anche queste leghe possono comportarsi come delle celle galvaniche microscopiche. Questa morfologia di corrosione è tipica delle leghe del rame dove quest’ultimo, essendo un metallo più nobile dei suoi elementi in lega, si comporta come catodo.
L’attacco selettivo si divide in 2 macro-famiglie:
- Dealligazione
- Corrosione intergranulare
La prima è abbastanza autoesplicativa: 2 metalli in lega, uuno più nobile dell’altro, il meno nobile viene disciolto dal più nobile.
La seconda invece è un pò più particolare: infatti quello che succede è che il grano del materiale si comporta in maniera più o meno nobile rispetto al reticolo. Questo comporta che o uno o l’altro andranno a corrodersi se messi in contatto tramite un elettrolita.
Questo processo è tipico delle ghise e delle leghe di alluminio; ma i protagonista di questo processo è l’acciaio inox per delle ragioni molto particolari che vedremo.
Dealligazione
La de-alligazione funziona su 2 meccanismi dettati dalla natura della lega
- Leghe bifasiche —-> Microcoppie galvaniche tra matrice e alliganto
- Leghe Monofasiche —-> Dissoluzione della lega e ri-depozione del metallo nobile
Come abbiamo detto appunto la de-alligazione è un processo tipico delle leghe di rame. In particolare gli ottoni (CuZn) subiscono un processo di dezinficazione, in particolare nell’ottone 60/40 dove abbiamo effettivamente una lega bifasica.
Per poter limitare questo effetto utilizziamo degli elementi in lega detti inibitori come fosforo, arsenico, piombo, stagno e alluminio, ma questi vanno bene solo per gli ottoni con una percentuale di zinco inferiore al 35%.
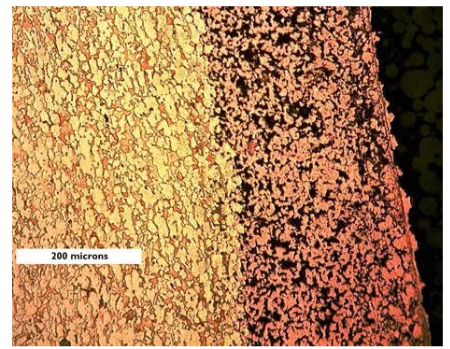

Per i bronzi invece avviene il processo di soluzione della lega e rideposizione del rame. Anche in questo caso esistono degli inibitori del processo che sono arsenico, antimonio e fosforo in quantità inferiori allo 0,2%. Questo tipo di leghe è largamente utilizzato in nautica sotto il nome di leghe ammiragliato.
Grafitizzazione delle ghise
Sempre sotto i processi di de-alligazione notiamo le ghise. Abbiamo visto in termodinamica, ma ripetiamo qui che il carbonio è più nobile della maggior parte dei metalli e dato che la ghisa è una lega ferro carbonio ricca di carbonio è soggetta anche lei alla de-alligazione.
Nota: per avere de-alligazione nelle ghise è necessario avere i cluster di grafite.


Morfologia di corrosione: Corrosione intergranulare
Questo tipo di corrosione è tipica delle leghe di alluminio e degli acciai inox, anche se con meccanismi diversi.
I primi si corrodono per la loro capacità di formare leghe intermetalliche, mentre i secondi per via di un fenomeno detto sensibilizzazione.
Le leghe di alluminio
Le leghe di alluminio corrodono per via della formazione di grani intermetallici. Questi possono essere anodici o catodici rispetto all’alluminio. In un caso abbiamo la corrosione della matrice di alluminio (caso di intermetallo anodico), nell’altro abbiamo la corrosine solo del grano esterno.
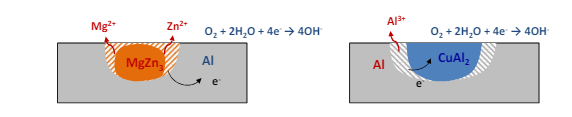
Acciaio inox
L’acciaio inox segue un processo simile, ma sul bordo di grano. Questo è il caso in cui la forza di un acciaio diventa la sua debolezza. Quello che succede è che con un riscaldamento e un successivo raffreddamento lento quello che succede è che il cromo si accumula sui bordi di grano come carburi di cromo. Questi si comportano da catodo locale e in presenza di un elettrolita e vanno a indebolire la coerenza tra i grani.
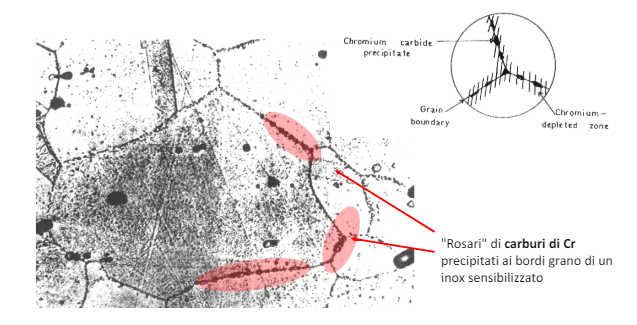
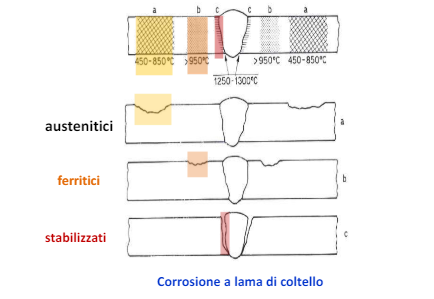
Questo tipo di sviluppo di carburi di cromo è tipico attorno le saldature e porta ad una corrosione a lama di coltello. Ovvero il cordone di saldatura rimane integro e viene attaccato solo il “bordo” della saldatura. Questo accade appunto per la “sensibilizzazione” dell’acciaio.
La posizione poi dipende dalla natura dell’acciaio preso in considerazione e ad eventuali inibitori inseriti in lega.
Altri tipi di morfologia di corrosione
In realtà ci sono altre morfologie di corrosione, ovvero quelle assistite da sforzo. In questo tipo di morfologia di corrosione in realtà abbiamo 2 effetti:
- La presenza di uno sforzo
- La presenza di un ambiente corrosivo
Presi singolarmente i 2 effetti non avrebbero effetti catastrofici, ma uniti insieme l’uno alimenta l’altro, in particolare con i meccanismi di corrosione in fessura.
Ma in questo articolo non li tratterò in maniera approfondita.
Anche per oggi è tutto. Per le nuove uscite pigia qui! Mentre per continuare con la serie clicca qui.
