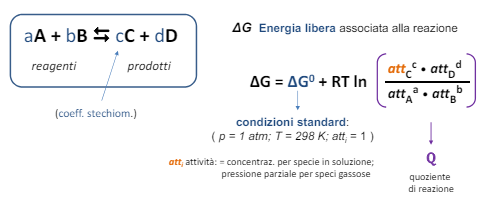
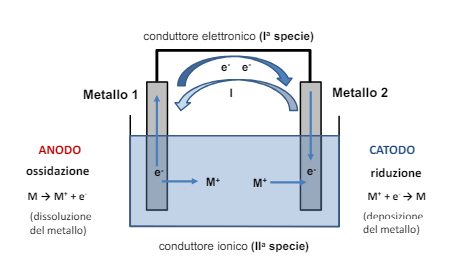
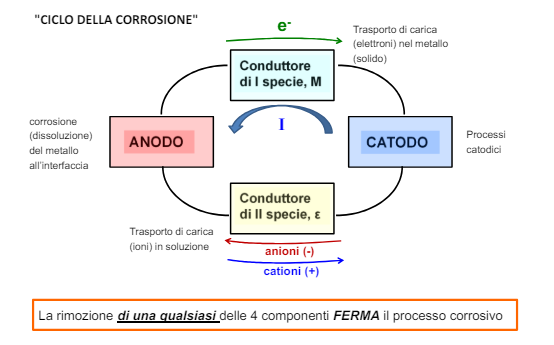
Abbiamo visto la termodinamica della corrosione che risponde alla domanda “La corrosione può avvenire?”. Ora la cinetica della corrosione ci dice “se avviene quanto velocemente?”.
Come l’articolo prima sarà molto tecnico e spero di lasciare comunque qualcosa a chi lo leggerà
E come prima, Iniziamo!!
La legge di Faraday
Possiamo intuire che, se la corrosione è formata da ioni positivi che abbandonano l’anodo, allora ci saranno tanti elettroni liberi di girare quanti ne sono gli ioni che se ne vanno.
Questa è la base della legge di Faraday, ovvero se la velocità di corrosione è la variazione di massa al passare del tempo
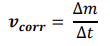
e la massa è formata da atomi metallici, allora la velocità di corrosione è proporzionale alla quantità di ioni che abbandonano l’elettrodo e di conseguenza è proporzionale agli elettroni liberi di girare e quindi alla corrente. Questo ci porta a introdurre la legge di Faraday per la cinetica della corrosione.
Dopo questo frasone lunghissimo vediamo la formula:
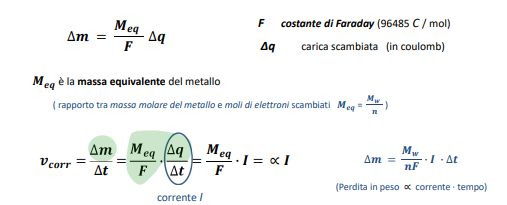
Applicato poi sull’area interessata abbiamo che la velocità di corrosione su unità di area è:
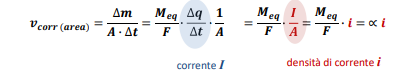
E da qui notiamo subito una cosa, ovvero che l’area è una componente importante della corrosione, in particola il RAPPORTO tra le aree di anodo e catodo fa la differenza. Infatti noi sappiamo che la corrente al catodo è la stessa corrente al catodo, ma allora se la corrente è costante abbiamo che più l’area dell’anodo è piccola, più forte sarà la concentrazione di correnti su unità di area. Questo comporta che la velocità di corrosione del catodo cresce al diminuire dell’area dello stesso.
Il circuito di della corrosione
Adesso abbiamo visto dalla termodinamica della corrosione un potenziale di cella, abbiamo appena visto una corrente di corrosione… Non ci ricorda qualcosa?
Certamente il processo di corrosione è assimilabile ad un circuito elettrico, e come un circuito elettrico è fornito di un generatore (la cella con anodo e catodo), delle resistenze e una corrente che lo attraversa (appunto la corrente calcolata dalla legge di Faraday).
Vediamo quindi qui sotto le varie componenti:
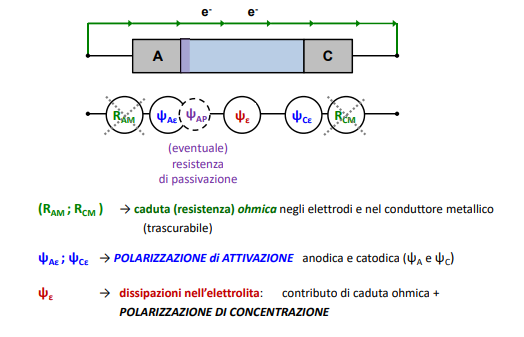
Vediamo che appunto i potenziali vengono modificati dalle polarizzazioni di attivazione, ovvero un certo sovrapotenziale che deve essere “sconfitto” prima di iniziare la corrosione.
Questo sovrapotenziale è dipendente dalla concentrazione dello ione metallico in un intorno dell’elettrodo.
Le rette di Tafel
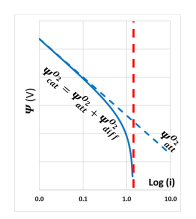
Esistono quindi delle curve di polarizzazione che mettono in relazione il “nuovo potenziale” con la corrente e sono dettate dalla legge di Butler-Volmer.

Che raccolte in maniera opportuna ed in funzione di E (potenziale) si ottiene: circa questa cosa qui in rosso
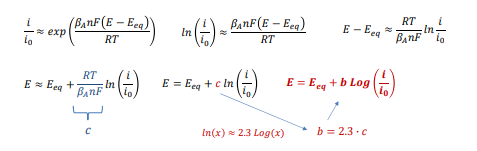
Approssimando questa cosa matematica brutta otteniamo la legge e i grafici di Tafel, ovvero le curve di comportamento anodico e catodico di un materiale.
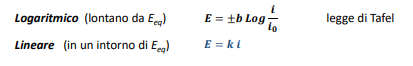
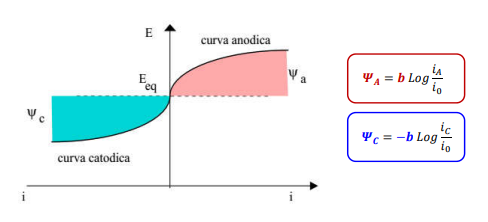
Mettiamo in scala logaritmica assoluta questo grafico e magia.
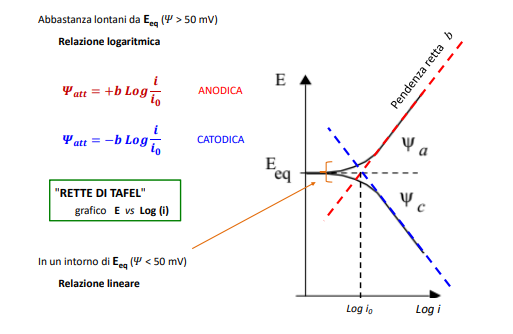
Le rette di Tafel ci dicono appunto come si comporta il metallo, in particolare
- La pendenza: al comportamento anodico più la pendenza è alta, più la velocità di corrosione sarà bassa, al comportamento catodico al crescere della pendenza avremo anche qui una cinetica lenta.
- La posizione rispetto all’asse y (E): al crescere della distanza cresce la corrente di scambio e quindi la velocità minima di corrosione
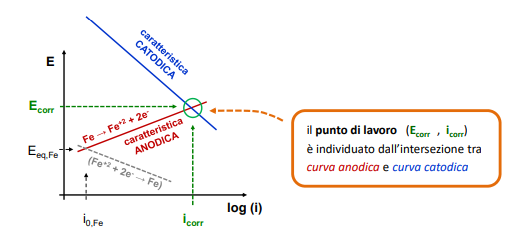
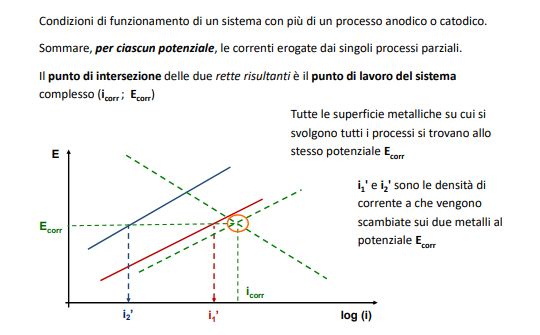
Andando a sovrapporre più curve di comportamento otteniamo quello che poi chiameremo punto di lavoro di cella.
Polarizzazione di attivazione
La polarizzazione di attivazione è una sorta di barriera energetica che si oppone alla corrosione. In parte è legata alla natura del metallo, in parte alla natura dell’elettrolita che lo circonda.
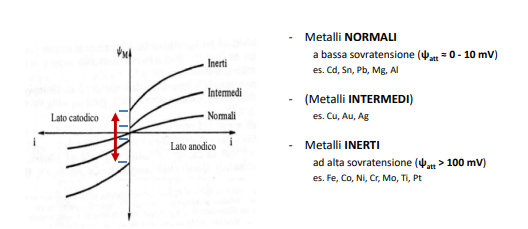
Questo comporta un certo distaccamento tra le curve che però è possibile trascurare poichè dell’ordine dei millivolt, ma ben più importante è il contributo dato dalla natura dell’elettrolita che circonda il materiale. Infatti se questo è “stagnante” attorno agli elettrodi si formerà una “coltre” di ioni di carica opposta all’elettrodo stesso (positiva per l’anodo, negativa per il catodo). Questa si opporrà al movimento delle cariche, ossia alzerà la tensione necessaria all’attivazione dei processi di corrosione.
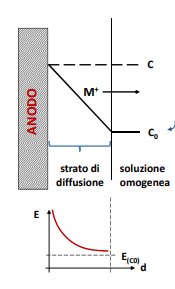
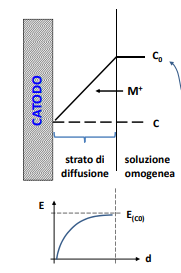
Reazioni catodiche
Ricordiamo che le reazioni catodiche importanti sono la reazione di sviluppo idrogeno e quella di riduzione ossigeno. Quest’ultima ha una particolarità, ovvero ha una corrente limite di accettazione dipendente dalla limitata velocità di consumo di ossigeno dell’acqua dipendente dalla concentrazione di ossigeno. Questo si verifica in particolare a elevate velocità di corrosione.
Punto di lavoro
Il punto di lavoro si trova intersecando la caratteristica anodica di un elettrodo con la caratteristica catodica di un altro. Questo è quindi il punto i comune dove le correnti sono uguali (vedi legge di Faraday sopra) e da qui è possibile quindi ricavare il potenziale di corrosione, ovvero la tensione tra i due elettrodi.
Fenomeni di passivazione
Il fenomeno di passivazione è la creazione di uno strato superficiale di film protettivo composto da ossidi o idrossidi. La natura dello strato è di fondamentale importanza, infatti deve rispettare le seguenti caratteristiche:
- Compatto
- Isolante
- Insolubile
- Adeso
- Rinnovabile
Lo strato di film passivante offre quindi una resistenza in più, ma spesso viene generato a determinate condizioni di tensione e corrente.
Il diagramma di Evans si trasforma quindi in questo modo:
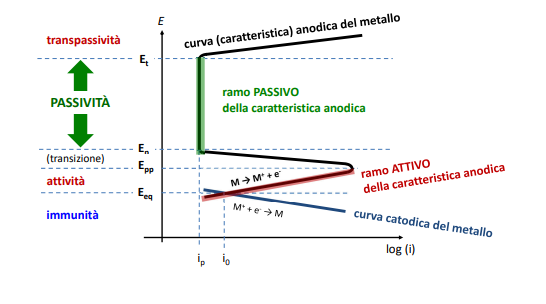
Vediamo quindi che circa in maniera istantanea al crescere della tensione oltre il ramo attivo la corrente di passività è inferiore alla corrente di scambio proteggendo così il materiale dalla corrosione.
La zona di passivazione è soggetta a cambiamenti dipendenti da altri elementi magari messi in lega al metallo all’anodo, un esempio è il Cromo che allarga la zona di passivazione in tutte le direzioni, oppure il molibdeno che alza il limite di transpassività.
Paragone termodinamica e cinetica
Possiamo vedere che questo comportamento trova riscontro anche nella termodinamica.
Infatti la cinetica della corrosione non può esserci senza una termodinamica favorevole.
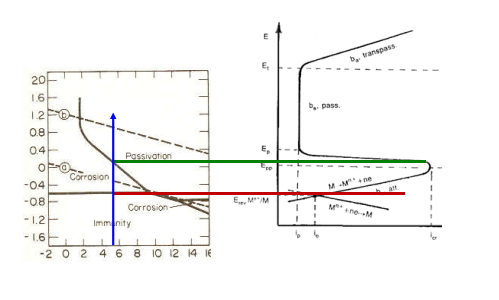
Avendo quindi il nuovo grafico possiamo vedere che:
- Se la reazione catodica attraversa solo la zona di attività allora la corrente di corrosione sarà quella solita
- se la reazione catodica attraversa solo la zona di passività allora la corrente di corrosione sarà o nulla o molto bassa
- Se la reazione Catodica invece attraversa lo stato di transpassività allora avremo fenomeni di corrosione localizzata perchè la tensione riuscirà a “sfondare” il film passivante in alcuni punti
- Se invece la Reazione catodica attraversa sia la zona di passività, sia la zona di attività, allora alla rottura del film avremo la corrosione sul danneggiamento con velocità di Icorr.
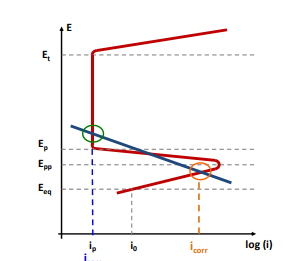
Da questi grafici e poi possibile pensare a dei controlli di corrosione cinetici che vedremo nell’articolo di protezione dei metalli dalla corrosione. Appunto la cinetica è importante perché per l’ingegneria un elemento che non si corrode e uno che si corrode di 0,0001 micron all’anno non hanno grandi differenze,
E Per quanto riguarda la cinetica della corrosione è tutto.
Se vuoi rimanere aggiornato clicca qui, oppure se vorresti leggere gli altri articoli di questa serie clicca qui.