Abbiamo visto fino ad adesso come funziona il processo della corrosione e come si presenta, e la domanda ora è: “come posso fermare questo processo?”. In realtà abbiamo visto che è impossibile annullare la corrosione, ma possiamo limitarne gli effetti prendendo delle precauzioni e utilizzando dei metodi di protezione.
Le 4 componenti della corrosione
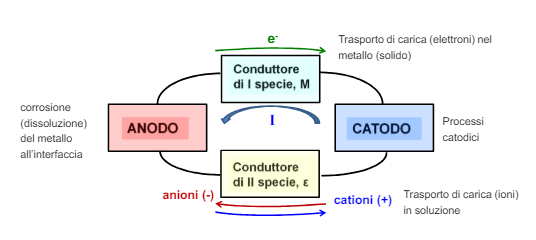
Abbiamo già visto questo diagramma e abbiamo detto che è sufficiente eliminare anche una sola delle componenti.
La componente che ha più senso “eliminare” è quella che già di suo ha una resistenza maggiore. Questa componente lo chiameremo “passo limitante”
Metodi di protezione
Il conduttore di prima specie nella cella elettrolitica è il cavo che collega anodo e catodo. Questo è il passo più difficile da limitare dato che è generalmente dato dal diretto contatto tra i 2 metalli. Infatti non si agisce mai sul primo passo ma piuttosto si agisce o sull’ambiente o sui due elettrodi. Tendenzialmente ci sono 3 metodi di protezione:
- modifica dei fattori ambientali
- modifica della superficie
- protezione elettrica
Modifica dei fattori ambientali: Il metallo
Il primo passo per proteggere un elemento dalla corrosione è ovviamente la scelta del metallo opportuno per l’ambiente che lo circonda.
La selezione è ovviamente dettata dal budget disponibile e si può o sceglier il materiale o inserire alligazioni nobilitanti o passivanti sullo stesso.
Prima bisogna capire su quale anodo agire:
- Fissato il processo catodico (quindi lavoro sull’anodo) posso o aumentare il potenziale anodico con alligazione nobilitante o aumentare il sovrapotenziale anodico con una alligazione passivante
- Fissato il processo anodico invece l’unica cosa che posso fare è aumentare il sovrapotenziale catodico inserendo in lega degli elementi che rallentino lo sviluppo idrogeno o la riduzione ossigeno.
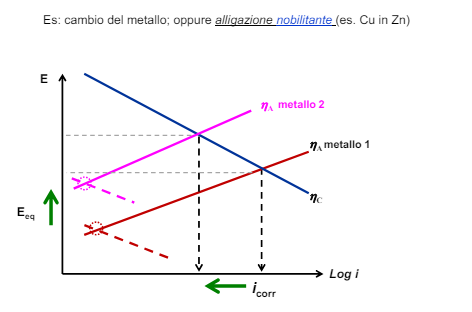
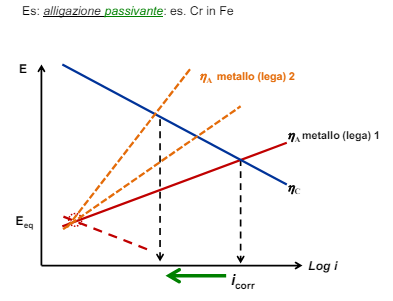
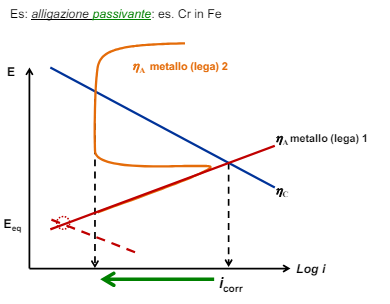
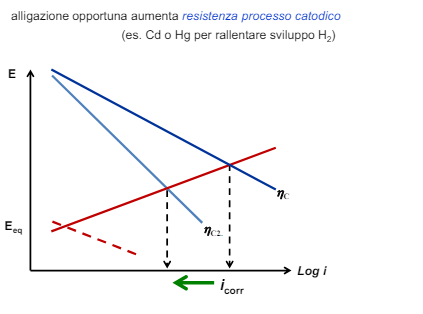
Modifica dei fattori ambientali: l’ambiente
Importanti almeno tanto quanto la scelta del metallo, ci sono i fattori ambientali da tenere in considerazione, in particolare la presenza di speci chimiche dannose, il pH e il tenore di ossigeno.
In generale è possibile controllare solo il tenore di ossigeno lavorando o sulla temperatura o aggiungendo in ambiente speci chimiche che reagiscono con l’ossigeno come il solfito di sodio e l’idrazina,
Inibitori di corrosione
Esistono delle sostanze chimiche che inducono reazioni parallele o competitive alla corrosione (abbiamo visto per esempio il cloro induce reazioni chimiche favorevoli alla corrosione) e si possono classificare in più modi:
- Per natura chimica
- Per utilizzo
- Per condizioni di impiego
- per meccanismo elettrochimico
Noi li classificheremo in quest’ultimo modo
Classificazione degli inibitori

Gli inibitori anodici invece si dividono in ossidanti e non ossidanti. Questi ultimi vanno a lavorare sulla curva di attività del metallo facendogli acquisire i comportamenti di un metallo passivato e nel caso questo sia già un metallo passivato, allargano il campo di passività.
Il meccanismo è quello di reagire con l’ambiente e creare superficialmente uno strato “passivato”, alcuni esempi possono essere i carbonati, i borati, i silicati ecc… .
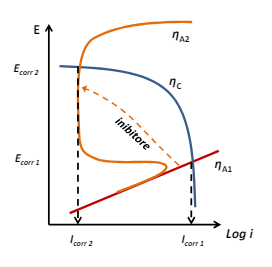
Di contro ovviamente ci sono gli inibitori ossidanti il cui meccansimo è lo stesso, ma reagiscono con l’ossigeno
Gli inibitori hanno alcune criticità, ovvero per arrivare a “passivare” il metallo li dobbiamo mettere in maniera omogenea e dovremmo assicurarci che la concentrazione sulla superficie sia sufficiente a passivare il metallo; inoltre sarà necessario mantenere la concentrazione di mantenimento nel tempo e tenere conto della vita operativa dell’inibitore. In seguito riportiamo alcuni inibitori tipici.
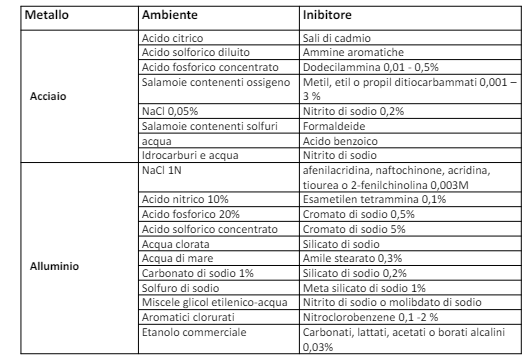
Metodi di protezione: Modifica della superficie
Un altro metodo per tenere sotto controllo la corrosione è quello di modificare la superfice e il metodo più intuitivo è quello di isolare la superficie dall’ambiente. In questo modo otteniamo un aumento del sovrapotenziale del metallo, ovvero una resistenza del circuito di corrosione.
Per fare questa operazione utilizziamo dei rivestimenti che si dividono nel seguente modo:
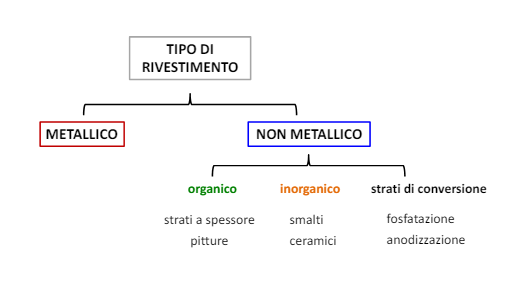
Questi rivestimenti li affronteremo uno ad uno, ma prima di applicare un rivestimento è di fondamentale importanza andare a preparare la superficie su cui applicarlo, in particolare pulirla.
Sembrerebbe un problema di poco conto, ma una buona pulizia implica una buona adesione dello strato e una difficolta maggiore nel presentarsi di problemi di corrosione localizzata o sottopelle.
Meccanismi di pulizia

Rivestimenti metallici
Gli obbiettivi dei rivestimenti metallici possono essere svariati:
– aumentare la resistenza all’usura,
– aumentare la durezza superficiale
– Migliorare l’estetica dei materiali
– Variare alcune proprietà funzionali come le funzionalià ottiche o elettroniche
– aumentare la resistenza alla corrosione
La divisione tra i rivestimenti metallici è relativa alla nobiltà del materiale rivestito, questo non solo funge da protezione fisica, ma anche da possibile protezione chimica alla corrosione.
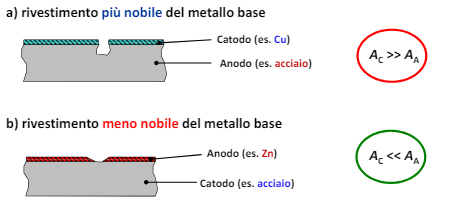
Nel caso in cui il rivestimento sia più nobile del metallo abbiamo
- Corrosione stimolata dal rapporto tra le aree sfavorevole
- Ostacolata da prodotti di corrosione che sigillano i difetti
- Ostacolata dalla possibile passività del metallo più nobile
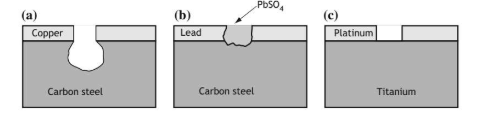
Nel caso contrario invece abbiamo un rapporto tra le aree molto favorevole e il metallo meno nobile funge da anodo sacrificale superficiale. L’esempio più lampante di una applicazione di questo genere sono i famosi tubi zincati o il rivestimento zincato tipico dei tralicci o delle scale anti-incendio.
Notiamo che a seconda della dimensione di un eventuale difetto gli effetti possono cambiare, in particolare potrebbe verificarsi una cella ad areazione differenziata all’interno di una cella elettrolitica.
Metodi per fare rivestimenti metallici
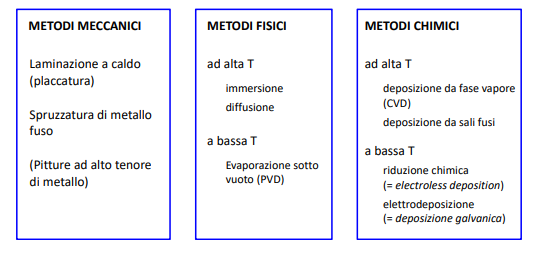
Esistono vari modi per poter rivestire un metallo con un altro metallo. Qui sopra abbiamo appunto una prima classificazione.
Per rivestire i metalli spesso servono delle tecniche per poter depositare un metallo di natura diversa sopra un altro e a volte servono degli strati di transizione da un metallo ad un altro. Vediamo quindi alcuni metodi
Placcatura
Abbiamo tutti visto dei metalli placcati, tipicamente nei gioielli per poter dare una parvenza di oro o argento. Questo metodo può essere effettuato a varie temperature:
- Se la temperatura è superiore a quella del metallo di rivestimento allora si dice che il metallo è sovrasaldato e come dice la parola si salda il metallo di rivestimento sulla superficie della superficie
- Se la temperatura invece è inferiore a quella di fusione del metallo di rivestimento otteniamo il rivestimento laminando i due strati uno sopra l’altro.
Spruzzatura
La spruzzatura è un processo in cui delle particelle del rivestimento vengono sparate sulla superficie da rivestire. I metodi di spruzzatura per i metalli implicano la fusione del metallo di rivestimento e il lancio di gocce di questa sostanza fusa.
La particolarità di questo processo è la possibilità di spruzzare anche materiali ceramici, ossidi o nitruri.
Per poter ottenere il metallo fuso lanciato si utilizzano delle tecniche al plasma in cui il plasma svolge le 2 funzioni contemporaneamente.
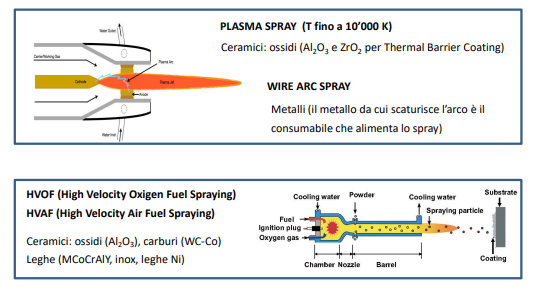
Pittura ad alto tenore di metallo
Per chi ha lavorato in un’officina meccanica o nel campo della carpenteria metallica questo strumento di protezione è molto noto. Esistono infatti delle vernici che contengono come pigmento del particolato metallico, tipicamente zinco, che svolgono la funzione di protezione catodica. Si utilizza principalmente sulle saldature o sui giunti ed è una soluzione relativamente economica e disponibile a chiunque.
Rivestimento metallico a caldo
Con i metalli bassofondenti come il piombo, lo stagno, l’alluminio (in casi particolari), il cadmio e lo zinco è possibile immergere il pezzo direttamente in un bagno di metallo fuso. Questo comporta una copertura più spessa e uniforme. Ed è l’ultima delle lavorazioni meccaniche
Deposizione fisica di vapori
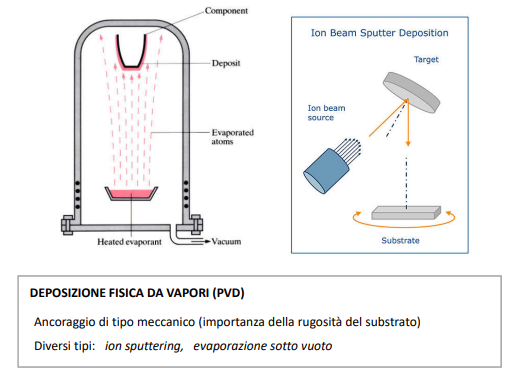
Questo tipo di deposizioni è fortemente dipendente dalla natura superficiale del substrato per l’ancoraggio.
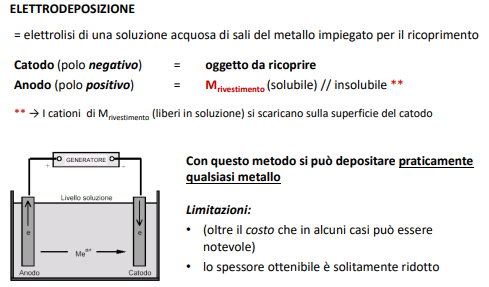
Elettrodeposizione
Questo metodo è quello che si usa per la cromatura delle parti metalliche e segue i principi della cella elettrochimica visti ad inizio corso di corrosione (qui)
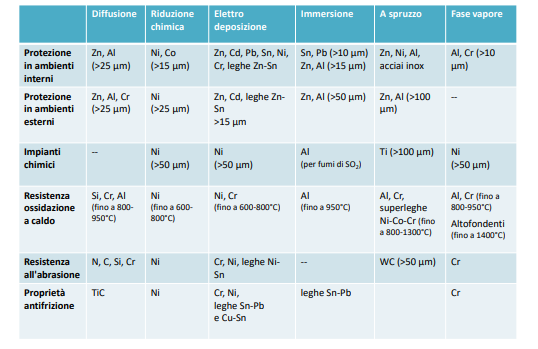
I metalli usati tipicamente per i rivestimenti sono i seguenti e con i seguenti metodi:
| Metallo | Metodo di rivestimeto |
| Zinco | Zincatura a caldo, a freddo e elettrodeposizione |
| Cadmio | Elettrodeposizione |
| Piombo | Immersione e Elettrodeposizione |
| Stagno | Immersione e elettrodeposizione |
| Alluminio | Immersione |
| Nichel | Elettrodeposizione, Riduzione chimica da sali e placcatura |
| Cromo, Nichel-Cromo | Elettrodeposizione |
| Rame | Elettrodeposizione |
| Oro | Elettrodeposizione e placcatura |
Metodi di protezione: Strati di conversione
Gli strati di conversione sono un film superficiale formato in situ, ovvero direttamente sul metallo da proteggere, tramite un legame chimico o elettrochimico. Questi possono essere utilizzati come strati anticorrosivi o come fondo per i successivi rivestimenti.
Fosfatazione
Il substrato metallico viene fatto reagire con dell’acido ortofosforico contenente ioni metallici fosfati. Questa reazione sviluppa idrogeno e crea uno strato poroso ottimo per le successive lavorazioni come la verniciatura o i metodi fisici di rivestimento.
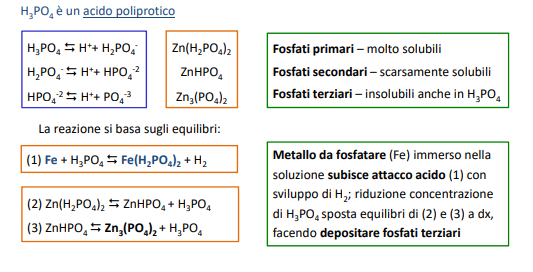
Cromatazioe

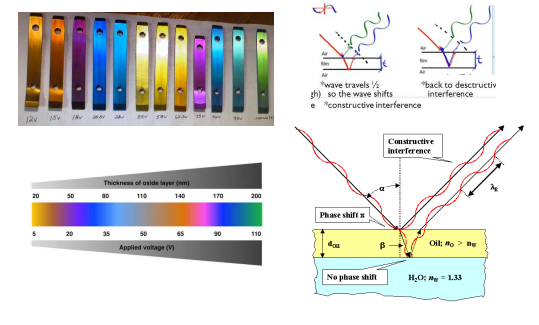
Anodizzazione
L’anodizzazione è un procedimento molto attuato, specialmente per l’alluminio.
L’obbiettivo è quello di inspessire lo strato di ossido protettivo tramite cella elettrochimica (andiamo a stimolare la produzione dello strato di passività).
In particolare per il titanio abbiamo anche la possibilità di far “cambiare colore” tramite dei fenomeni di diffrazione dello strato di ossido (lo spessore dell’ossido è direttamente correlato alla frequenza di luce respinta).
Metodi di protezione: Rivestimenti organici
Ora che abbiamo visto il mondo dei rivestimenti metallici, andiamo a vedere il più economico e accessibile mondo delle protezioni organiche, ovvero le vernici.
La composizione delle vernici è la seguente:
- Legante: è la sostanza chimica che tiene insieme tutto e lega la vernice al substrato su cui viene applicata.
- Solvente/diluente: servono per la messa in posa della vernice e tendenzialmente a vernice asciugata o li troviamo presenti in quantità ridotta o non li ritroviamo affatto.
- Pigmenti/ cariche : i pigmenti sono solamente il colore mentre le cariche aiutano a migliorare le caratteristiche meccaniche della vernice e possono influenzare la permeabilità della stessa
- Additivi: servono a migliorare le prestazioni della vernice e possono spaziare da acceleratori di asciugatura, antiossidanti, agenti di attivazione superficiale ecc.
Le vernici si classificano inoltre in base al processo di indurimento che la governano:
- Indurimento per evaporazione del solvente(fisico)
- Indurimento per ossidazione (il legante ossida e indurisce)
- polimerizzazione
Il procedimento per una corretta verniciatura è quello che segue

La vernice inoltre ha ben 2 effetti protettivi sul substrato, ovvero la protezione fisica e meccanica dall’acqua isolando la componente dall’ambiente e in caso di presenza di pigmenti attivi anche quella di protezione catodica come abbiamo visto appunto le vernici allo zinco o anodica come le vernici al minio di piombo (questa non si usa più per la sua tossicità, ma largamente utilizzata per esempio sulla torre Eiffel o sul ponte di Brooklin in anni passati).
Metodi di protezione : Protezione elettrica
Dopo aver visto tutti i sistemi di protezione “passivi” andiamo ora a vedere quello più particolare e talvolta attivo.
Questo tipo di protezione si usa solo in ambienti altamente conduttivi come acqua di mare, terreno o ambienti particolari.
L’idea è quella di abbattere il potenziale di corrosione tra due elettrodi limitando la corrosione al suo minimo.
Abbiamo anche qui 2 categorie ovvero la protezione attiva catodica e anodica.
Protezione catodica
Fissato il processo catodico andiamo a lavorare sulla tensione a cui si trova il metallo aggiungendo o un elettrodo insolubile o uno solubile (anodi sacrificali)
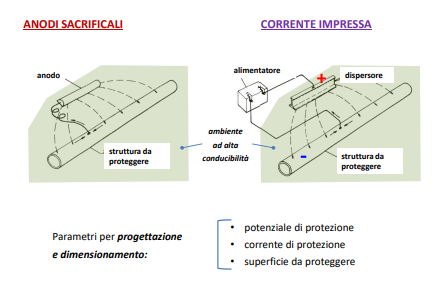
Per quanto riguarda gli anodi solubili la teoria è molto interessante: infatti collegando con un filo il metallo da proteggere con l’anodo, la tensione di lavoro della struttura si abbassa a sommandosi a quella dell’anodo che andrà a corrodersi a favore della struttura stessa. Questo metodo è molto utilizzato sia in campo marino che in campo civile per proteggere tubature e cavi sotterranei. Questo tipo configurazione però favorisce lo sviluppo idrogeno sulla superficie del metallo da proteggere.
Il dimensionamento di questi anodi è una procedura abbastanza complessa senza entrare nei dettagli segue i seguenti passi:

E anche per oggi è tutto. Considerate che questo piccolo minicorso è solo il primo della serie e spero di poterlo mettere scaricabile in PDF. Per rimanere aggiornato clicca qui!!
Mentre per altri articoli sulla scienza dei materiali clicca qui.
