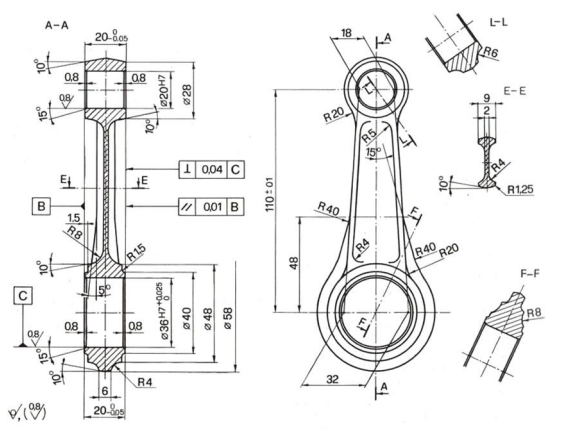
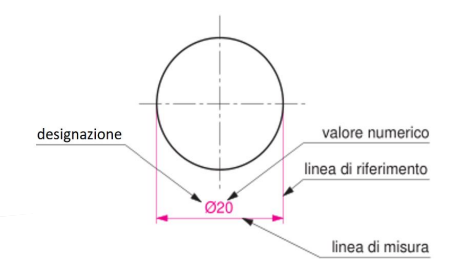
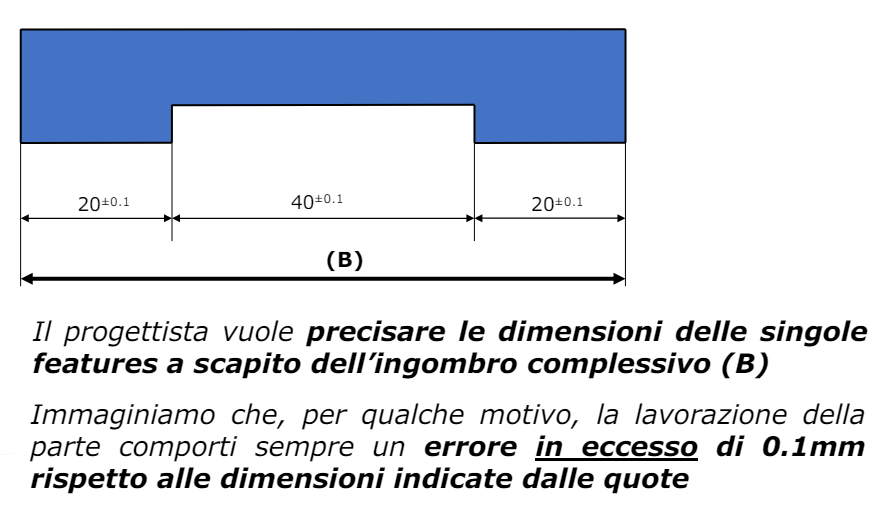
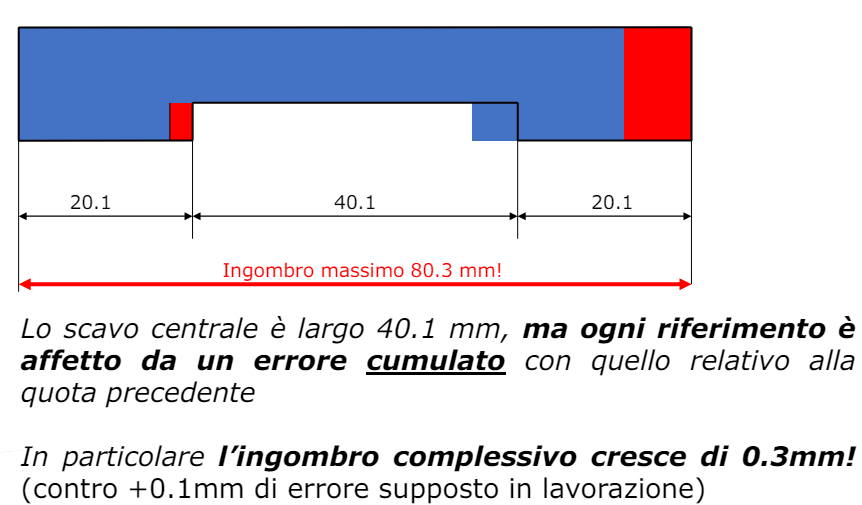
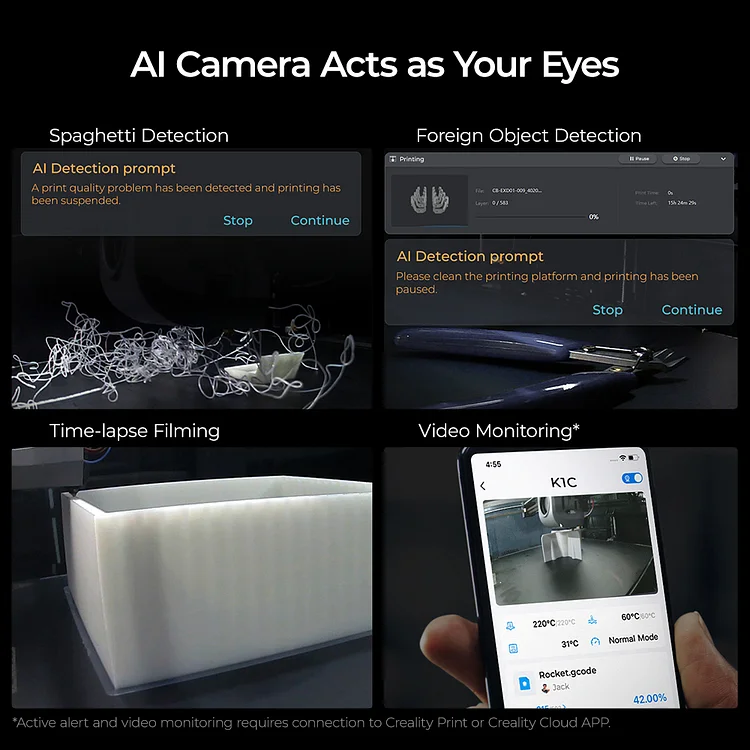
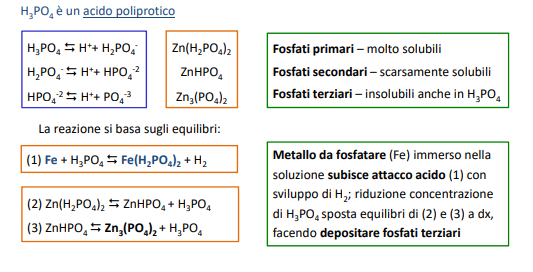
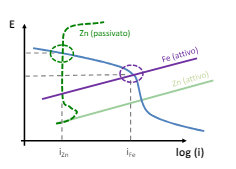
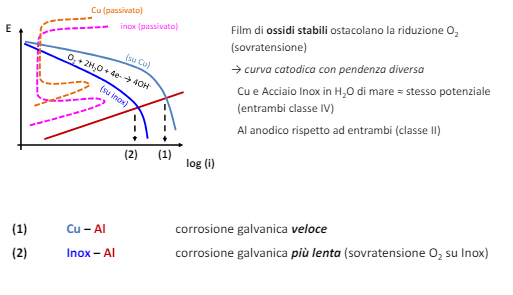
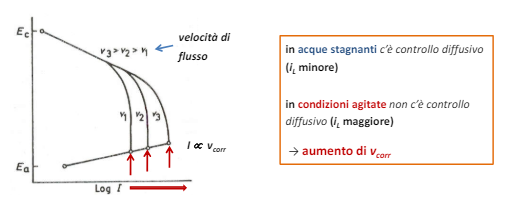
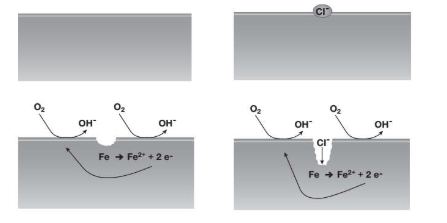
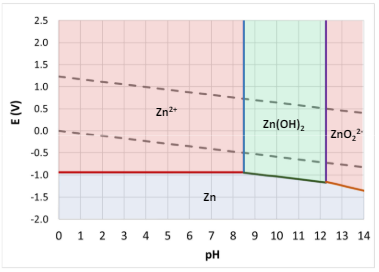
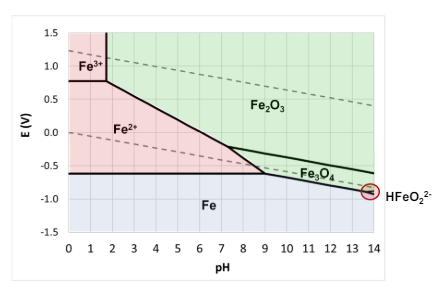
Per transizione energetica elettrica si intende il passaggio da fonti di energia fossili (limitate) a fonti di energia rinnovabili (abbastanza energia da approssimarla ad infinita in tempi umani). Il comparto elettrico sta dando il maggior contributo alla transizione energetica e quindi verrà affrontato in questo corso.
All’interno di questa transizione energetica da combustibili fossili a fonti rinnovabili abbiamo una sempre più spinta elettrificazione dei consumi con nuovi utilizzatori come veicoli elettrici o device tecnologici. Più il tempo passa vediamo che la quantità di utilizzatori elettrici stanno aumentando sempre più. Senza l’energia elettrica questi utilizzatori non avrebbero senso di esistere per via del basso rendimento o della bassa efficienza. Prendiamo per esempio i cicli frigoriferi o i motori delle macchine industriali: essi non avrebbero senso di esistere all’infuori del vettore energetico elettrico.
Inoltre dopo il decreto Bersani vi è stata una liberalizzazione del mercato energetico consentendo anche ai privati di produrre energia.
All’interno di questa transizione abbiamo anche il passaggio da un sistema di produzione centralizzato, grandi centrali vicine alle città, a un sistema distribuito (generazione di energia direttamente al’utilizzatore), o misto centralizzato distribuito.
Il momento della transizione energetica arriva con la maggiore consapevolezza del riscaldamento globale dove ci si è accorti che è fondamentale ridurre l CO2 in atmosfera. Inoltre il tempo che ci rimane per prendere provvedimenti a riguardo è molto limitato prima che il processo sia irreversibile.
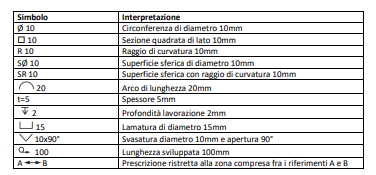
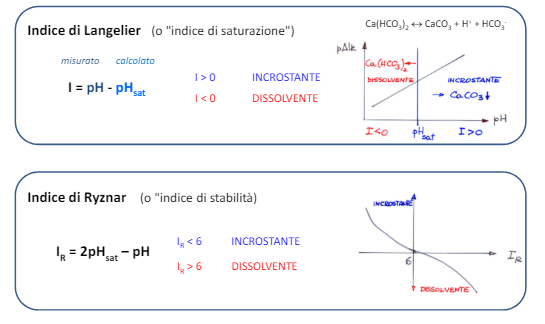
TerminOlogie utili
–Prodotti energetici: prodotti estratti o catturati da prodotti naturali, da cui è possibile ricavare energia e sono per noi risorse primarie, che possono essere non rinnovabili come il carbone, o rinnovabili come il fotovoltaico.
–Energia rinnovabile: energia che una volta consumata si ripristina e può essere consumata nuovamente.
–Energia non rinnovabile: una volta consumata non può rinnovarsi.
–Energie alternative: energie che vengono prodotte senza combustibili fossili; di queste fa parte anche l’energia nucleare.
–Vettori energetici : sostanze che possono essere utilizzate per creare movimento e lavoro meccanico come benzina, energia elettrica, idrogeno ecc.. (tutto quello che non si estrae dalla natura )
Le fonti di energia rinnovabile utili alla transizione energetica
Possiamo vede dal grafico che l’idroelettrico sostiene la crescita delle energie rinnovabili, ma il suo contributo è concluso e il settore è saturo. Possiamo quindi contare per procedere con la nostra transizione energetica su altri tipi di fonti di energie. Vediamo che il solare sta avendo una forte crescita e un grosso impatto sulla produzione di energia che è possibile prevedere ancora più spinta nei prossimi anni.
Vediamo inoltre che la crescita delle rinnovabili ha superato in termini di produzione gas e carbone.
Infatti vediamo sempre dal grafico che la produzione in termini energetici da parte del carbone è di circa 2.1 TW mentre dalle fonti di energia rinnovabili (Renewable Energy Sources) siamo arrivati a toccare circa i 2.5 TW di potenza.
Vediamo inoltre dal grafico che la quantità di centrali alimentate a carbone e gas nel mondo sta diminuendo a favore delle fonti di energia rinnovabile.
Questo non solo da un punto di vista di adozione delle soluzioni rinnovabili, ma anche dal punto di vista economico vediamo che le fonti di energia rinnovabile stanno ricevendo sempre più finanziamenti e investimenti.
Vediamo qui i trend di crescita nella soddisfazione del fabbisogno energetico globale come le energie rinnovabili hanno soppiantato il petrolio, raggiunto a livello percentuale il nucleare e come, visto appunto il trend di crescita esponenziale, raggiungeranno presto l’idroelettrico e eventualmente i combustibili fossili.
Inoltre sappiamo che l’Europa punta a portare le fonti di energia rinnovabili al 40% e dai grafici sottostanti è possibile vedere come i vari membri europei stiano pian piano abbandonando il fossile per passare al rinnovabile.
Perché sta avvenendo questo cambiamento
1 la limitata disponibilità delle fonti non RINNOVABILi
Secondo degli studi abbiamo disponibili ancora circa 1500 miliardi di barili di petrolio,ma allo stesso tempo ne consumiamo circa 90 miliardi all’anno dandoci così all’incirca 15 anni di autonomia
Quindi abbiamo che le risorse naturali sono finite e prossime a finire.
Anche economicamente costa sempre di più estrarre le fonti fossili portando così a un rendimento economico minore che spinge a estrarre sempre di meno e a essere un settore, quello dell’estrazione, sempre meno sostenibile.
Inoltre ci troviamo in un periodo in cui in breve tempo arriveremo all’apice di molti fenomeni correlati ad un maggiore fabbisogno di energia tra cui:
- la scarsità di cibo (servirà più energia per produrlo)
- la scarsità di acqua
- la sovrappopolazione (più persone hanno più bisogni energetici)
la presa di coscienza del riscaldamento globale
Siamo sempre più coscienti del fatto che il cambiamento climatico sta avvenendo, grazie alla presa di posizione di comunicatori migliori degli ingegneri e scienziati; infatti quest’ultimi sin dagli anni 70 sostengono che il cambiamento globale esiste e va affrontato.
Inoltre appunto anche in economia vediamo che i rischi maggiori sono legati al fallimento delle procedure per contenere il riscaldamento globale.
Quindi una eventuale catastrofe ambientale porterebbe di conseguenza anche a una catastrofe economica.
le cOnseGUENZE del riscALDAMENTO globale
- l’innalzamento del livello del mare con la perdita di località costiere (vedi Venezia);
- lo scioglimento dei ghiacciai che comporta la diminuzione delle riserve di acqua dolce;
- Inoltre avremo una percentuale maggiore di vapore acqueo nell’aria che comporta dei cambiamenti a livello climatico come la minor frequenza di piogge ma con un aumento della violenza della precipitazione;
- la presenza di nuove malattie o allergie dovuta alla migrazione di animali e piante da una parte all’altra del mondo per poter rimanere nel loro clima ideale;
- la diminuzione di biodiversità
L’insieme di questi cambiamenti porterà a problemi locali per determinate popolazioni che migrando porteranno a problemi economici e politici non indifferenti (da qui l’alto rischio).
In termini temporali facendo alcuni conti abbiamo circa fino al 2030 per poter invertire il trend di crescita della temperatura e come primo baluardo di questo cambiamento è necessario ridurre drasticamente le emissioni di gas serra che, come vediamo dal grafico,è direttamente correlata alla crescita della temperatura.
Vediamo che il comparto energetico è uno dei grandi emettitori di gas serra e di conseguenza è uno dei comparti che cambiando può influire sempre più positivamente sulla quantità delle emissioni.
Per il settore dei trasporti di grandi dimensioni come navi e aerei non abbiamo una strada da percorrere per poter trasformare il movimento a sola energia rinnovabili.
ma come dato positivo vediamo che non c’è stato dal 2018 al 2019 una crescita delle emissioni globali nonostante la crescita economica del 2.2% e nel 2020 abbiamo avuto una caduta del 7% delle emissioni di CO2.
la scarsa qualità di vita nelle zone più inquinate come le grandi città
Vediamo che nel corso del tempo bruciando combustibili fossili la qualità dell’aria nelle grandi città sta peggiorando a vista d’occhio tanto da portare le persone a non uscire di casa se non munite di mascherine filtranti (questo anche pre-covid).
la decrescita dei costi e i prezzi delle fOnti di energia rinnovabile
Il costo delle energie rinnovabili è forte in decrescita, in particolare il fotovoltaico sta diventando la fonte di energia più economica al mondo in proporzione alla quantità di energia prodotta soppiantando addirittura i combustibili fossili.
Vediamo inoltre che il nucleare sta diventando sempre più costoso e sta venendo abbandonata come fonte di energia; infatti
negli ultimi anni stanno venendo costruite solo centrali prototipo e le centrali preesistenti sono economicamente sostenibili solo perchè sono già state ammortizzate. Inoltre una centrale nucleare moderna ha bisogno di molti più sistemi di controllo rispetto a una più vecchia aumentando così i costi di costruzione.
Il nucleare comunque è una forma di energia che potrebbe farci da ponte e portarci dal fossile fino al rinnovabile dato che con le enormi quantità di energia prodotta è u a solida base per le esigenze del mercato.
Non è una soluzione nemmeno il catturare e riciclare l’anidride carbonica dall’aria dato che le poche centrali producono troppa poca energia per i consumi e i costi sostenuti.
facilità e velocità di installazione e scalabilità
Vediamo che le rinnovabili sono le più veloci da installare e possiamo quindi velocizzare la transizione energetica. Inoltre permette di diversificare la fonti e rendere delle zone geografiche energeticamente indipendenti.
Infatti molti produttori e distributori si stanno spostando sul rinnovabile alimentando così la crescita. Inoltre anche l’utilizzo dell’energia sta cambiando ,infatti dato che l’energia elettrica da fonti rinnovabili ha la priorità di consumo (semplicemente perché è un’energia aleatoria e si fa molta fatica a immagazzinarla) sta diventando sempre più “consumata” dal pubblico.
Dal grafico sopra vediamo che andando avanti con il tempo che l’umanità sta spostando l’utilizzo di energia da fonti fossili all’utilizzo di energia elettrica. Per esempio è sempre più comune avere un fornello elettrico o a induzione che permette di riscaldare senza dover bruciare materiale.
Il mercato delle fonti rinnovabili
Vediamo dal grafico una forte crescita del settore rinnovabile a livello di produzione di potenza mentre notiamo una certa stabilità nella produzione di energia da fonti fossili.
Il grafico sopra fa vedere chi e dove investe in energie rinnovabili:
– il settore pubblico investe solo per il 21% mentre il privato per il 79%
- la maggior parte degli investimenti sono utilizzati nella parte asiatica del mondo (42%)
- infine vediamo che il 47% dei soldi è diretta in fotovoltaico.
Inoltre il fabbisogno energetico mondiale sta aumentando e l’unica risorsa energetica che è possibile considerare infinita è l’energia solare.
Rimangono però due grossi problemi dal punto di vista energetico: il settore della generazione del calore e quello dei trasporti che esulano anche se solo in parte alla transizione energetica elettrica.
Conclusioni
La transizione energetica elettrica sta avvenendo ma sarà molto lenta dato che il sistema energetico ha un’inezia economica enorme e il cambiamento sarà molto lento.
Ma la fase degli idrocarburi sta finendo e l’unica risposta è il comparto dell’eolico e del fotovoltaico.
Ma la chiave è la presa do coscienza dell’economicità del solare e del fatto che non è possibile sostenere le altre fonti di energia.
Anche per oggi è tutto, questo articolo come gli altri della serie Elettrotecnica sono letteralmente appunti presi a lezione e un po’ riadattati.
Per rimanere aggiornato clicca qui!!
Mentre per altri articoli di elettrotecnica clicca qui.